EASL2020:在研乙肝新药ABI-H2158 1b期临床研究结果发布
HBV核心蛋白在HBV生命周期的多个步骤中起着不可或缺的作用。ABI-H2158是致力于针对乙型肝炎病毒(HBV)和与微生物组相关疾病创新疗法开发的临床阶段生物公司AssemblyBiosciences开发用于治疗慢性乙型肝炎感染的第二代HBV核心抑制剂。
在本届欧洲肝病学会年会(EASL2020)上,研究人员报告了一项在慢乙肝者中进行的ABI-H2158Phase1b期研究结果,该项研究主要评估该药的抗病毒活性,药代动力学(PK)和安全性。

在每个队列中,9名患者(7名用药患者,2名安慰剂[Pbo])被以盲法随机分配每天接受一次ABI-H2158100mg、300mg或500mg或安慰剂组,持续14天。符合条件的患者为年龄≥18岁且≤65岁的男性或女性,未接受过抗HBV治疗,HBeAg阳性且HBVDNA≥2×105IU/mL、MetavirF0-F2。
在第1、8和15天检测HBVDNA,pgRNA,HBeAg,HBsAg和HBcrAg。在第1和14天评估药代动力学(PK)。通过治疗紧急不良反应事件(AE)和实验室参数评估安全性。
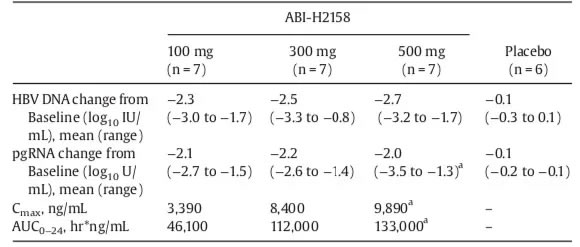
在整个队列中,受试者的平均(范围)年龄为36岁(19-51岁),其中大多数是男性(59%),亚洲人(96%)和HBVC基因型(59%)。在基线时,HBVDNA的平均(范围)为8.0log10(4.7-9.1)IU/mL,pgRNA为6.8log10(5.2-7.9)U/mL,ALT为40(14-124)U/L。表1展示了从基线到第15天的HBVDNA和pgRNA的变化以及药代动力学(PK)数据。
据报道,接受ABI-H2158的患者中有38%(8/21)出现不良反应事件(AE),接受安慰剂治疗的患者中有50%(3/6)出现了不良反应事件(AE)。大部分AE属于1级。没有一个是3级或4级,重度或导致治疗中断。头痛是接受ABI-H2158用药超过1名患者(2名)报告出现的唯一不良反应事件(AE)。
在接受ABI-H2158的患者中有71%(15/21)的患者出现了分级的实验室异常,而接受安慰剂的患者中有50%(3/6)的患者出现了异常,其中接受ABI-H2158治疗的患者有24%(5/21)出现ALT暂时性升高(所有1级),接受安慰剂治疗的患者有33%(2/6)出现ALT暂时性升高(1例1级;1例3级)。
这项Phase1b期研究结果表明,每天一次ABI-H2158给药,总共14天,该药具有强大的抗病毒活性和良好的安全性,支持在Phase2期与核苷(核苷酸)类似物联合进行进一步评估,目前该药已在进行Phase2期临床研究,并且在国内也有临床试验开展。(更多肝病新药研究信息敬请关注“肝脏时间”微信公众号)!
声明: 不要轻信任何医疗广告或新闻报道式广告! 请勿轻信素未谋面的网络医生! 本站所刊载的信息仅供参考,不能代表医生的诊断和治疗,请勿直接对照治疗而延误病情! 因个人主职工作时间不宽裕,网站未来仅保持不定期更新。










全部评论:暂无评论